![]()

免疫分型(immunophenotyping)是指根據存在于細胞表面、核或細胞質中的標記物或抗原的類型,利用基于抗體的對異質細胞群進行分析,以鑒定多種目標細胞群的存在及比例。通過使用特異性識別不同細胞類型標記物或抗原的抗體,從而幫助鑒定細胞的譜系。例如腫瘤標志物的檢測、浸潤免疫細胞的分析、白血病的診斷等。免疫分型可以利用組織切片(新鮮或固定組織)通過免疫組化方法以及利用細胞懸液通過流式細胞術進行分析。
流式細胞術可以說是用于探測人類免疫表型的首選技術,特別是由于它可以在諸如血液的復雜混合物中通過測量許多單個細胞上的多個參數,從而鑒定和分析包括稀有亞群在內的許多細胞亞群。并且由于可用的抗體試劑的擴大和實驗方案的不斷調整,流式細胞術不僅可用于評估細胞表面蛋白的表達,還可以用于評估胞內蛋白的表達或修飾水平以及細胞因子的水平。
T細胞
T淋巴細胞可在CD3表達的基礎上被免疫表型化,隨后進一步細分(如CD8+殺傷性T細胞和CD4+輔助性T細胞)。此外,T細胞表型是靈活的,可以隨不同的微環境發生變化;表型也可能重疊在多個T細胞群體之間。此外,T細胞亞群的分類還可能是根據響應某些刺激或磷酸化免疫信號蛋白(如STAT蛋白)而分泌的特定細胞因子水平來確定。
![]() 殺傷性T細胞(又被稱作細胞毒性T淋巴細胞,CD8+)能識別抗原,這些抗原是由感染因子釋放的,并與宿主細胞結合。殺傷性T細胞能夠識別多種細胞類型和病原體并與之相互作用。T細胞受體與外源抗原結合,觸發細胞毒素向受感染細胞釋放,導致細胞死亡。殺傷性T細胞的主要鑒定標志物就是CD8+,但是如果需要根據不同生理狀態下對殺傷性T細胞進行功能鑒定,還可以進一步增加其他標志物形成標志物組合。比如,對殺傷性T細胞進一步定義幼稚、中央記憶性、效應記憶性和效應T細胞亞群的經典標志物是基于趨化因子受體7(CCR7;也稱為CD197)和CD45RA(或CD45RO)的表達情況;對殺傷性T細胞進一步分析其活化狀態是基于HLA-DR和CD38的表達情況1-3。
殺傷性T細胞(又被稱作細胞毒性T淋巴細胞,CD8+)能識別抗原,這些抗原是由感染因子釋放的,并與宿主細胞結合。殺傷性T細胞能夠識別多種細胞類型和病原體并與之相互作用。T細胞受體與外源抗原結合,觸發細胞毒素向受感染細胞釋放,導致細胞死亡。殺傷性T細胞的主要鑒定標志物就是CD8+,但是如果需要根據不同生理狀態下對殺傷性T細胞進行功能鑒定,還可以進一步增加其他標志物形成標志物組合。比如,對殺傷性T細胞進一步定義幼稚、中央記憶性、效應記憶性和效應T細胞亞群的經典標志物是基于趨化因子受體7(CCR7;也稱為CD197)和CD45RA(或CD45RO)的表達情況;對殺傷性T細胞進一步分析其活化狀態是基于HLA-DR和CD38的表達情況1-3。
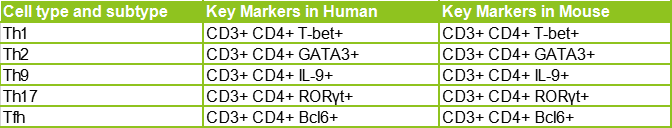
![]() 輔助性T細胞(即Th1、Th2、Th9、Th17和Tfh細胞等)具有很少的細胞毒性活性并且分泌對其它白細胞(例如B細胞、巨噬細胞、嗜酸性粒細胞或中性粒細胞)起作用以清除病原體的細胞因子。除了CD4這一共有標志物,不同輔助性T細胞還有各自的常用鑒定標志物組合,如下圖所示:
輔助性T細胞(即Th1、Th2、Th9、Th17和Tfh細胞等)具有很少的細胞毒性活性并且分泌對其它白細胞(例如B細胞、巨噬細胞、嗜酸性粒細胞或中性粒細胞)起作用以清除病原體的細胞因子。除了CD4這一共有標志物,不同輔助性T細胞還有各自的常用鑒定標志物組合,如下圖所示:
![]() 調節性T細胞(即Treg)在維持免疫穩態中起著重要作用,并且也與許多自身免疫性疾病有關4。迄今為止,已確定了兩種主要類別的CD4+Treg:組成型表達CD25和FoxP3的天然Tregs(nTreg)以及誘導后激活表達CD25和FoxP3的誘導型Tregs(iTreg)5。人和小鼠Treg的CD25表達情況不同。在小鼠中,所有CD25+細胞都被認為是Treg;而在人的免疫系統,只有那些高水平表達CD25的細胞被認為是Treg6。
調節性T細胞(即Treg)在維持免疫穩態中起著重要作用,并且也與許多自身免疫性疾病有關4。迄今為止,已確定了兩種主要類別的CD4+Treg:組成型表達CD25和FoxP3的天然Tregs(nTreg)以及誘導后激活表達CD25和FoxP3的誘導型Tregs(iTreg)5。人和小鼠Treg的CD25表達情況不同。在小鼠中,所有CD25+細胞都被認為是Treg;而在人的免疫系統,只有那些高水平表達CD25的細胞被認為是Treg6。
iTreg來源于胸腺,在某些抗原和專門的免疫調節細胞因子(如TGF-1、IL-10和IL-2)的刺激下,由單陽性CD4細胞分化為表達CD25和Foxp3的Tregs6。還報告了iTreg群體具有一定的可塑性,可以轉化為其他T細胞亞型,例如Th1和Th17細胞6。
目前,FOXP3是Treg的最明確的標記,盡管有報道發現少數Treg亞群是FOXP3-7。轉錄因子Foxp3作為Tregs的標志又進一步推動了其他的Treg標記的發現,包括CD127。若干已發表的報告證明CD127表達與Foxp3呈負相關8。比如,利用CD4+、CD25+和CD127-組合分選策略,可用于獲得體外可擴增的Treg細胞。
Bioss具有豐富的T細胞分型相關產品,代表產品如下:

另外,Bioss近期正在進行直標一抗的試用和專屬優惠活動,很多免疫細胞分型標志物相關多種熒光標記一抗位列其中,可以滿足您的多種需求,并有三重好禮等您來拿!讓您足不出戶,立享熒光盛宴!
http://www.yes000.com/newslook_02.asp?id01=419&typetype=1
參考文獻:
1.Sallusto F, et al. Nature. 1999; 401:708–712.
2.Tussey L, et al. Eur. J. Immunol. 2000; 30:1823–1829.
3.Appay V, et al. Nature Med. 2002; 8:379–385.
4.Cools N, et al. Clin Dev Immunol. 2007;891-895.
5.Chatenoud L, Bach JF. J Clin Invest. 2006;116: 2325-2327.
6.Schmetterer, Klaus G. et al. The FASEB Journal. 26 (6): 2253–2276.
7.Otsubo K, et al. Clin Immunol. 2011 Oct;141(1):111-20.
8.Liu W, et al. J Exp Med. 2006;203:1701-1711.